钴/有机光氧化还原双催化实现1,5,10-烯二炔的环化
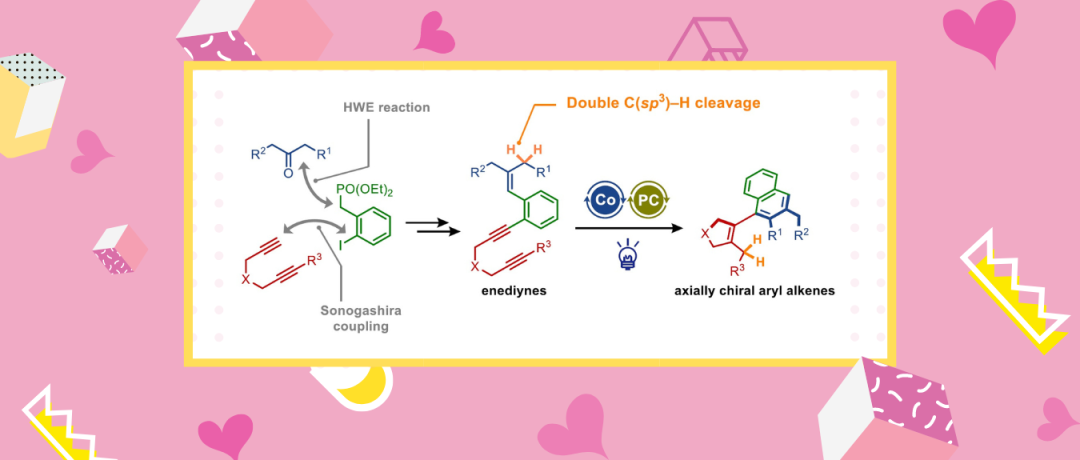
过渡金属催化剂活化C-H键构筑C-C键,无需底物预官能团化,便可合成各种复杂的有机分子。C(sp3)–H官能团化是一种实现原子经济性有机合成的理想转化方法。然而,由于缺乏与过渡金属中心相互作用的π或π*-轨道,直接和选择性活化C(sp3)–H键具有很大的挑战性。为了克服这个问题,通常需要导向基团(DGs)来促进底物中特定C(sp3)–H键的选择性活化。然而,DG的安装和移除会降低C-H官能团化策略的合成价值。因此,在没有DG的情况下进行位点选择性的C(sp3)–H官能团化是非常可取且有挑战性的。作为过渡金属催化炔烃和烯烃环加成反应的关键中间体,金属环能够从简单的不饱和底物中快速获得各种碳环和杂环骨架。大多数情况下,金属环与π组分反应,也可参与C–H键的活化。不同于传统的仅基于活化π-键的环加成反应,金属环介导的位点选择性C–H键活化环加成(CMCA)可以简单地组装复杂的多环分子。然而,迄今为止,只报道过少数CMCA实例,其中大多数受限于叔丁基的C–H键活化。此外,相比于DG辅助的C–H官能团化中固定的活化位点,CMCA 根据底物的不同,C–H活化位点可以从γ位置灵活地变化到ζ位置(相对于金属),但具体实现方法还有待进一步开发。
近日,日本名古屋大学(Nagoya University)Takeshi Yasui和Yoshihiko Yamamoto课题组通过钴/有机光氧化还原双催化实现1,5,10-烯二炔的C–H键活化,进而构建轴向手性芳基烯烃(Scheme 1C)。该反应通过位点选择性烯丙基C(sp3)–H键活化进行,无需DG。
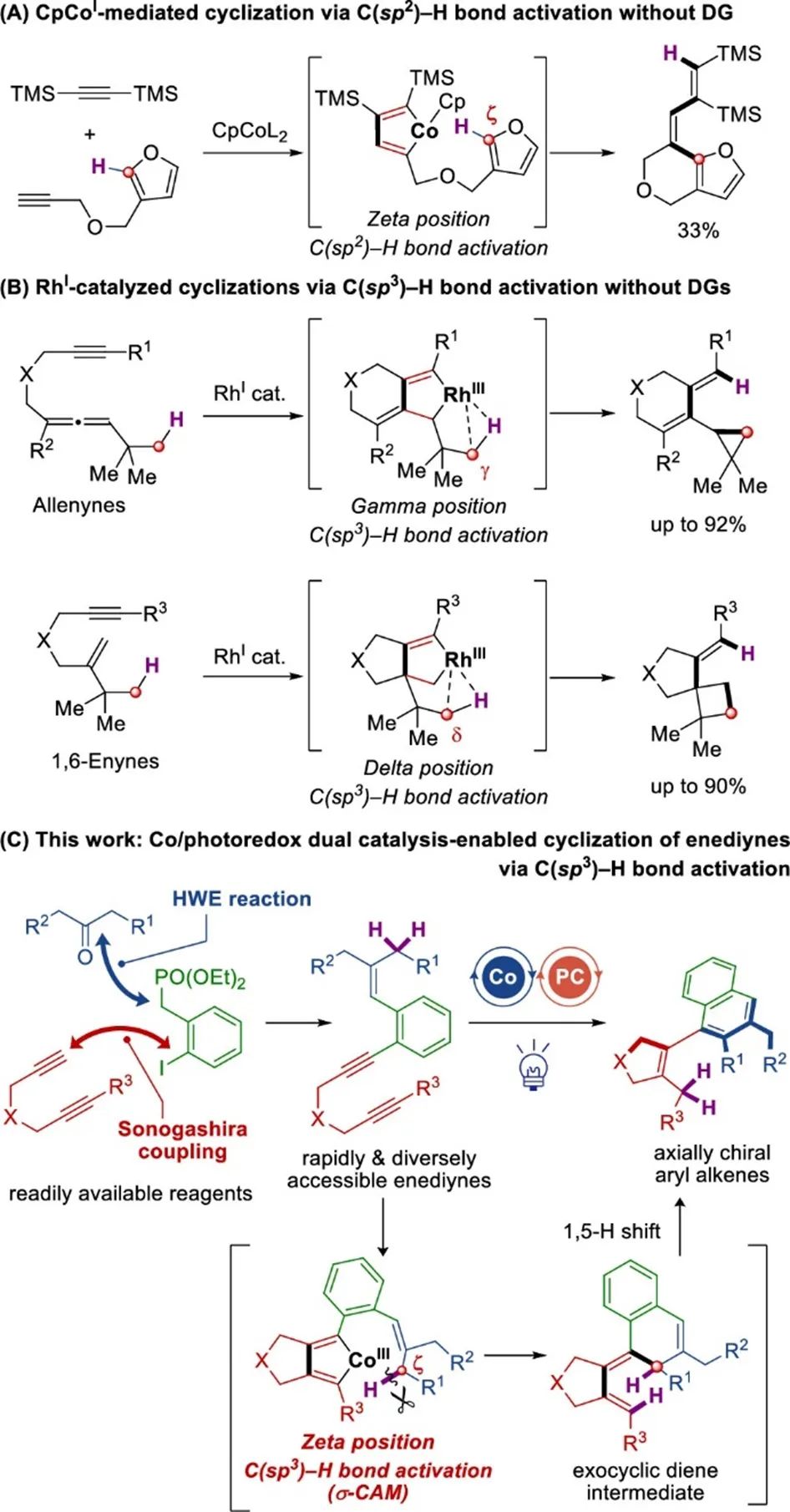
Scheme 2展示了1,5,10-烯二炔1a制备方法(产率80%)。
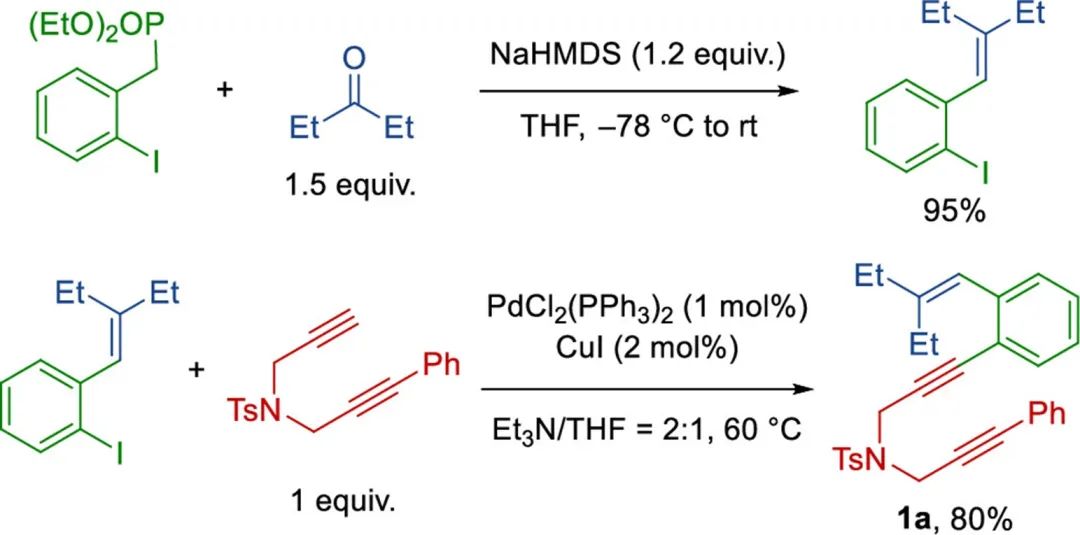
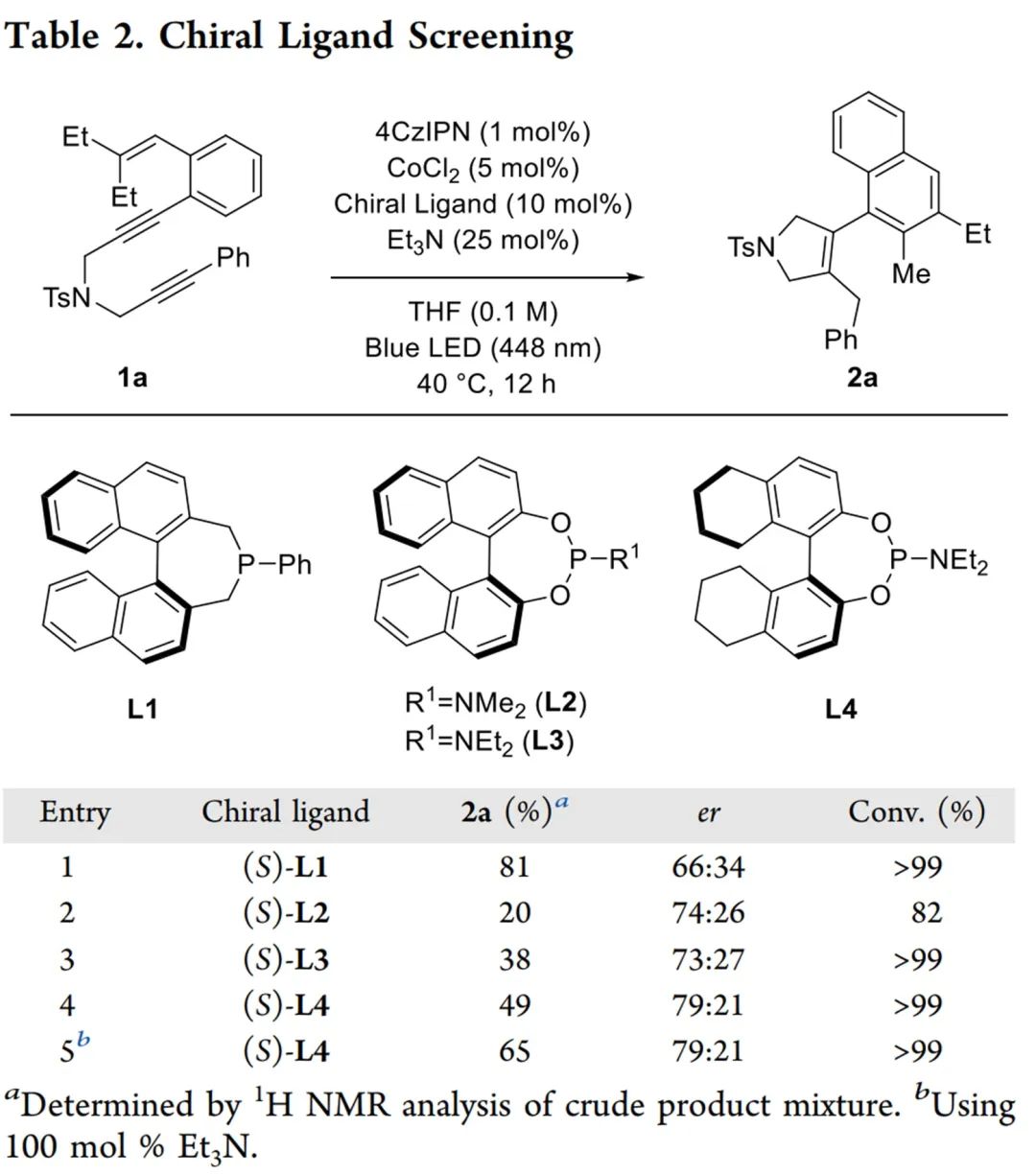
首先,作者进行了条件筛选,发现1,5,10-烯二炔1a ,25 mol% Et3N,CoCl2/PPhCy2和4CzIPN在0.1 M THF中,40°C下蓝光LED照射12 h,可得到轴向手性1-萘取代的环烯烃2a,收率81%(Table 1)。
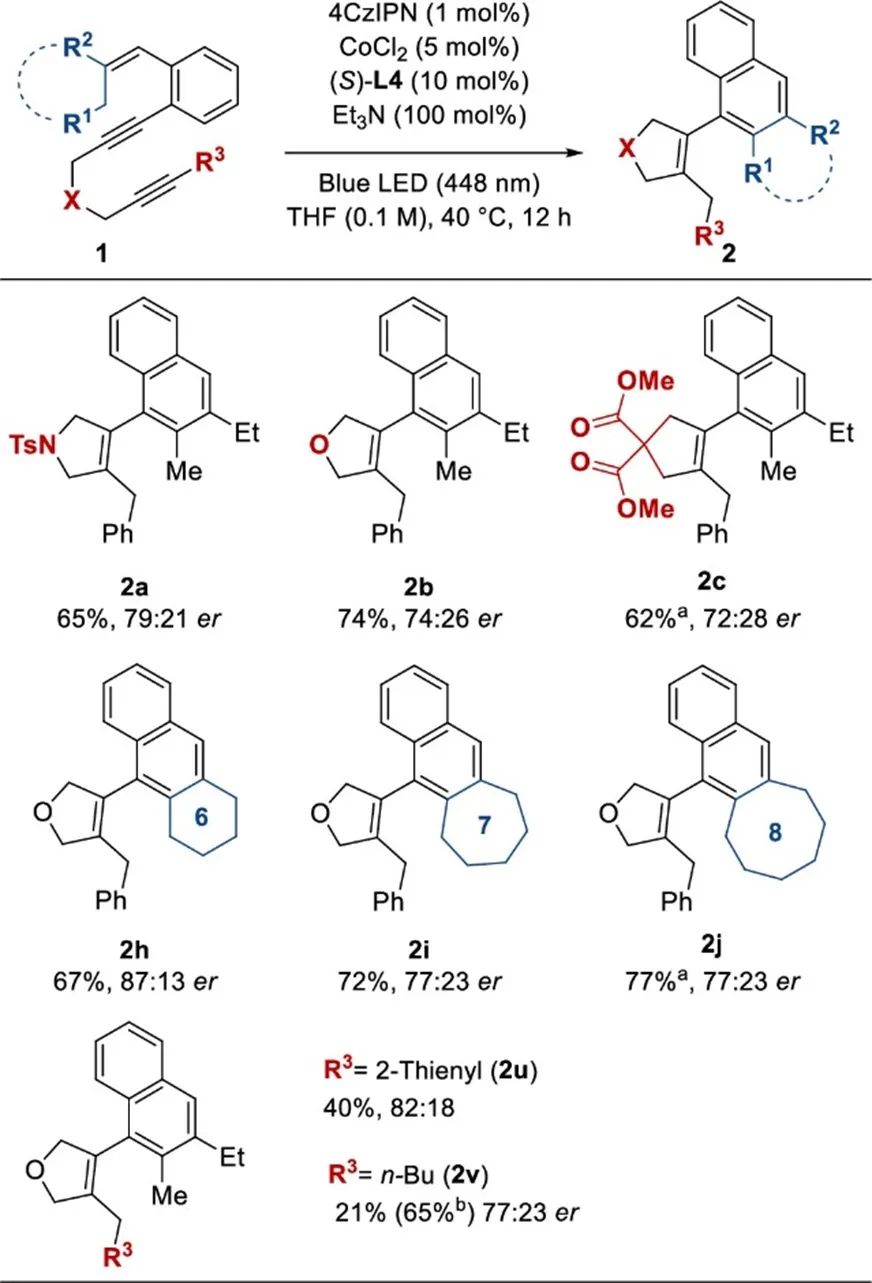
接下来,作者探索了级联CMCA/1,5-H位移的底物范围(Scheme 3)。化合物1中两种炔烃之间扭带部分会影响反应效果(2b-2e)。底物1中烯烃上的取代基耐受性良好(2g-2j)。
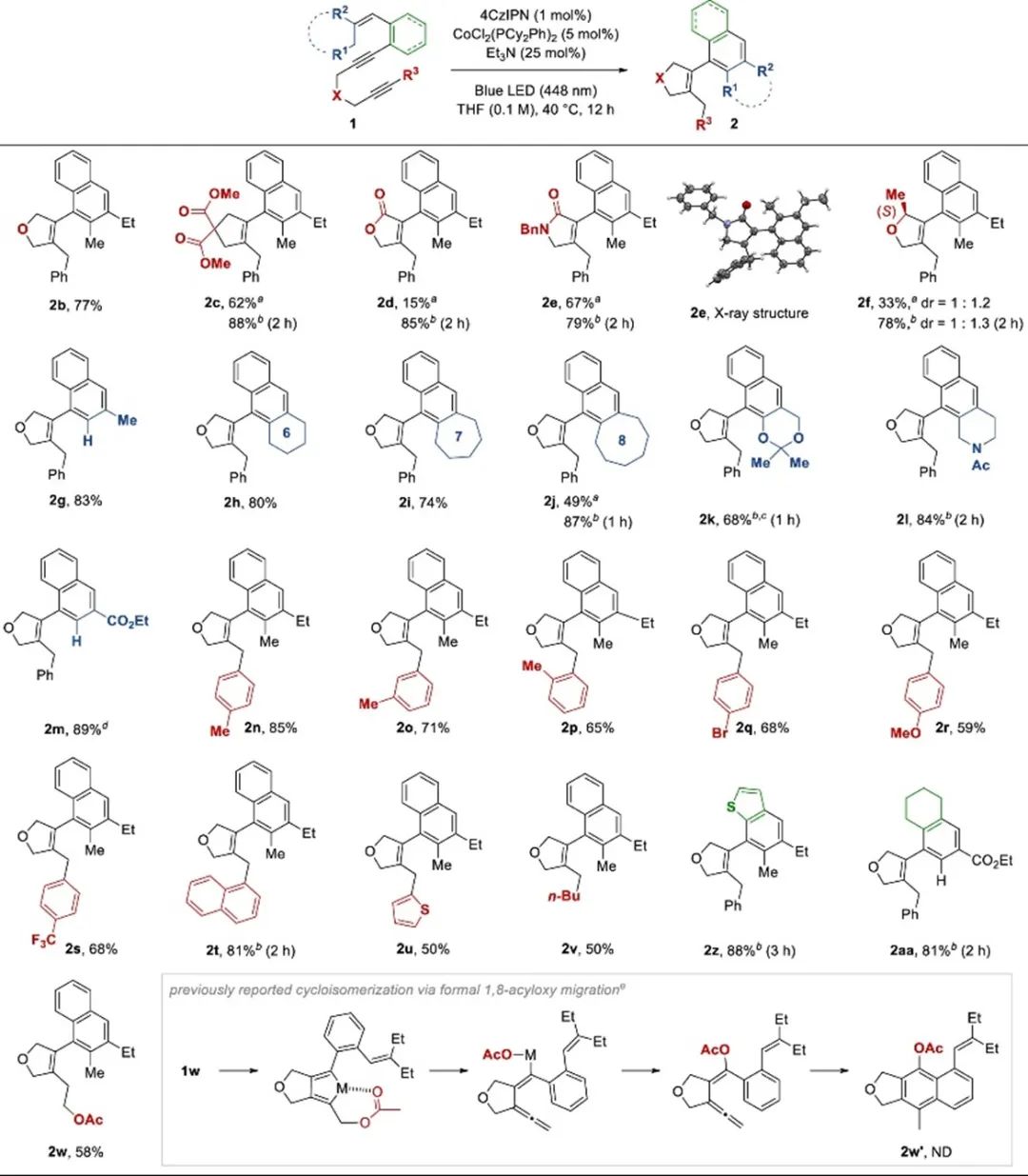
随后,作者通过对照试验阐明反应机理(Scheme 4)。作者假设反应是通过金属中间体进行的。烯炔4和1-苯基-1-丙炔没有反应。带有(E)-1-丁烯基的烯二炔5没有转化成环加合物6,表明C-H键活化发生在与亚苯基顺式连接的烷基上。氘代标记实验得到78%的2g-d7,说明氘原子掺入到烯丙基位置。动力学同位素竞争实验得到1:1的2g和2g-d7混合物。结果表明,ζ位的C-H键活化不是决速步骤。
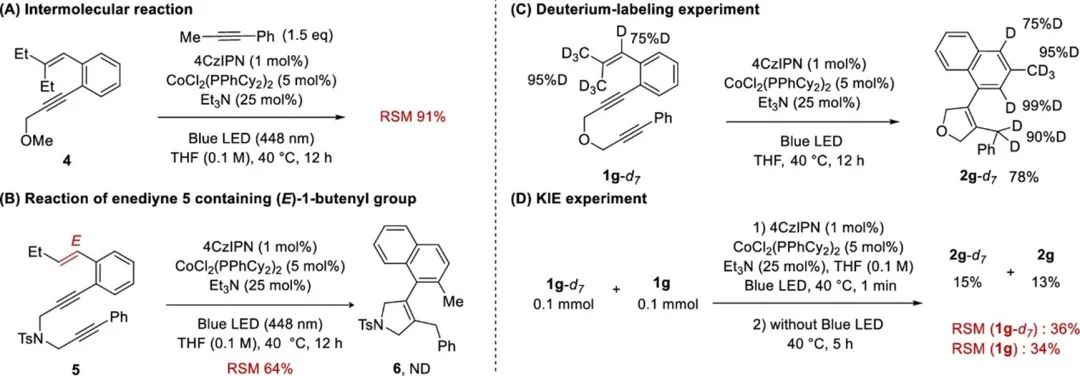
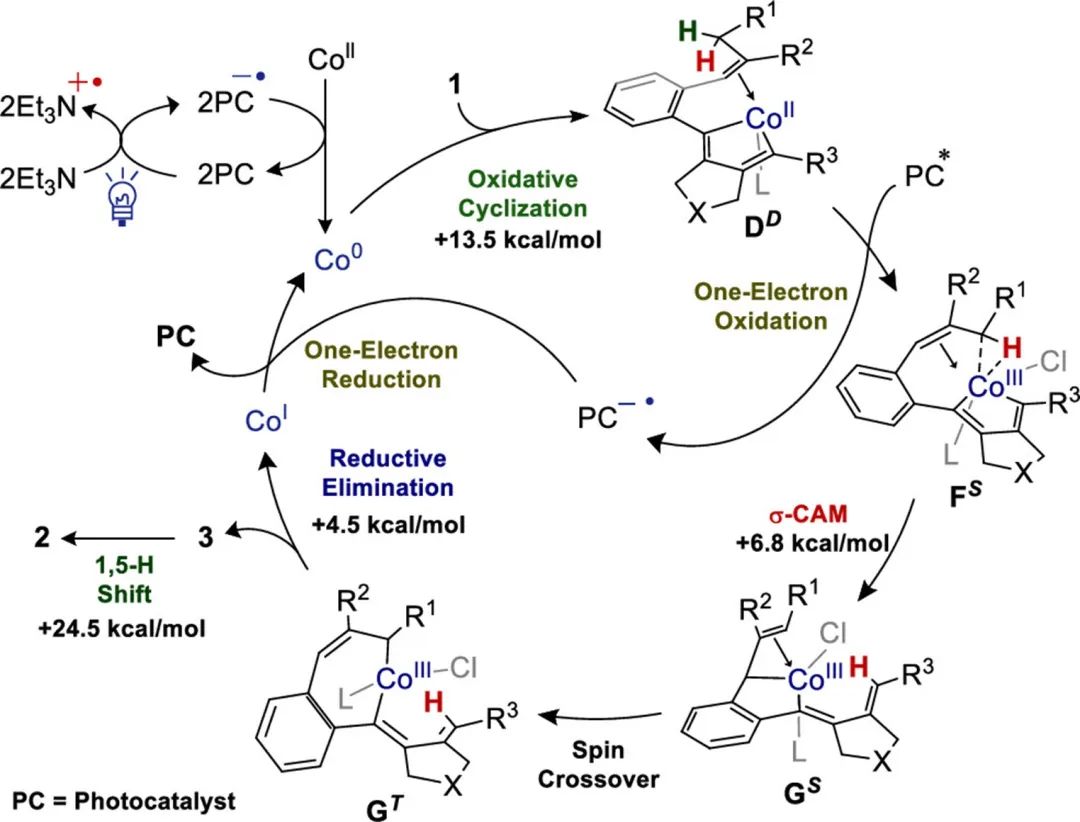
为了进一步了解反应机理,作者进行了理论计算(Figure 1)。用Co0研究初始氧化炔-炔偶联,以PMe3为模型配体。二重自旋态的炔-炔耦合通过TSABD进行,活化能为ΔG‡=+13.5 kcal mol–1,目的是提供四面体金属配合物BD。随后烯烃配位到BD的钴中心得到更稳定的四方锥配合物CD。PMe3和侧链烯烃之间空间排斥,其中一个PMe3配体解离,形成DD。这些计算说明氧化炔-炔偶联是决速步骤,这与KIE实验结果保持一致。
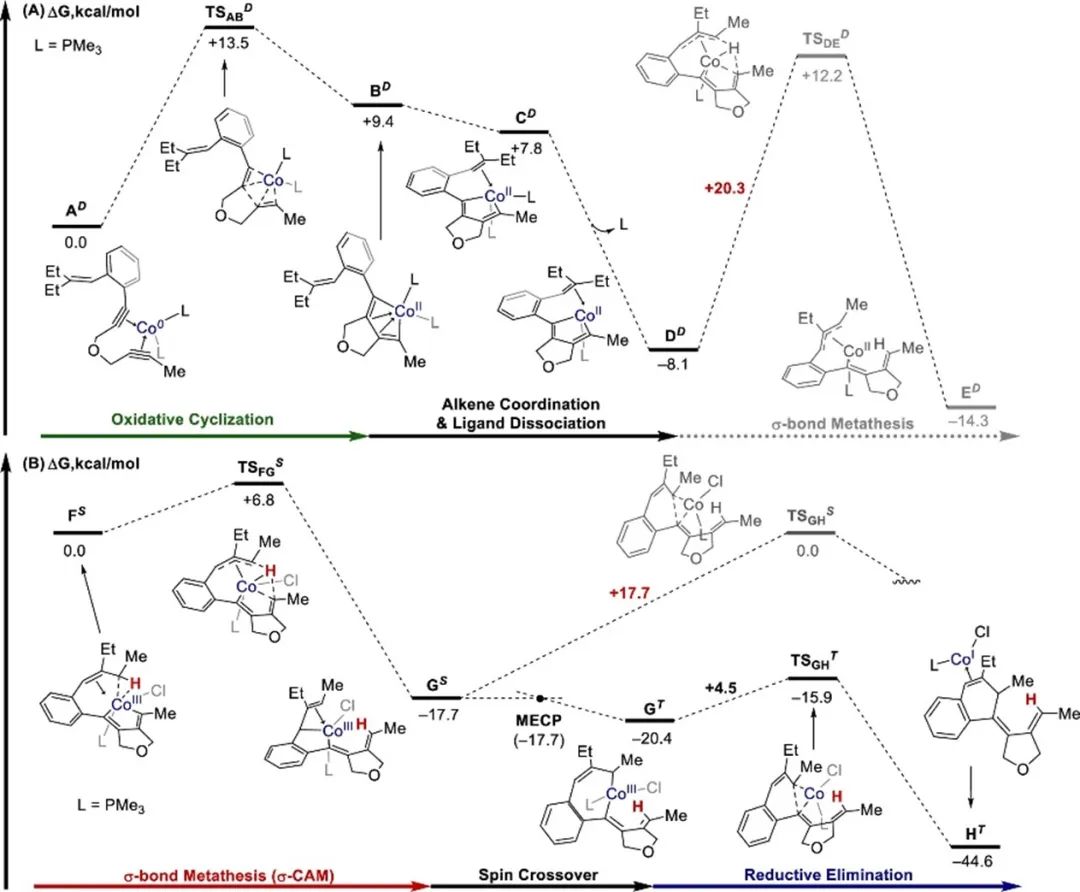
相对较短的Co-H键长度(1.83 Å)和Co-H-C键角(105°)说明钴中心和烯丙基C-H键之间的相互作用存在于FS中(Figure 2A)。在配合物GS中,钴中心与新形成的C(4)–H键之间有相互作用(Figure 2D)。这些结果表明C(sp3)–H键是通过σ-CAM进行活化的。由于DD的钴中心没有d空轨道与相应的C(sp3)–H键相互作用,DD不会出现这种相互作用(Figure 2B)。因此,它无法将C-H键引导到金属中心附近,导致DD发生不利的σ键复分解。
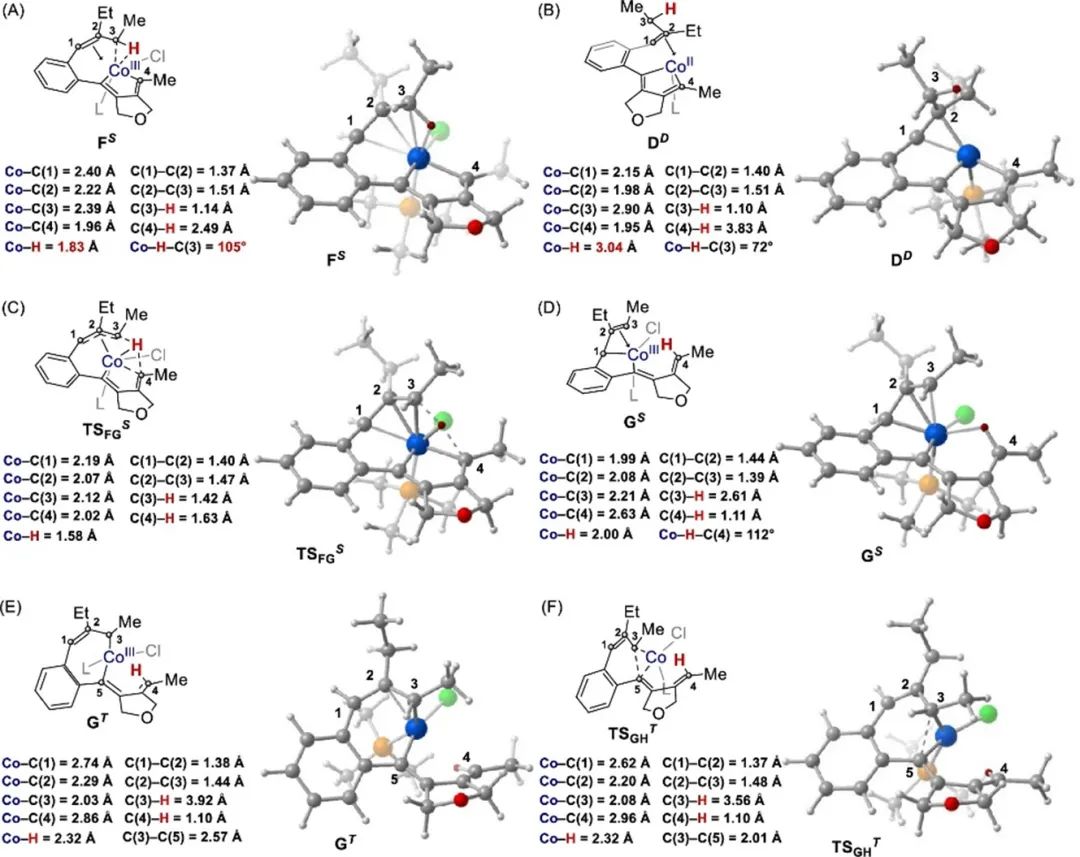
基于对照实验和DFT计算,作者提出了一种合理的反应机理(Figure 3)。首先,光诱导还原CoII物种产生Co0物种。氧化的炔-炔物质与Co0物种偶联形成二价金属DD,随后光诱导氧化生成三价金属FS。通过σ-CAM,C(sp3)–H键活化得到了五元钴环状化合物GS。自旋交叉生成七元钴环状化合物GT,还原消除得到外环二烯中间体3和CoI物种。3发生1,5-H位移最终得到轴向手性芳基烯烃产物2。
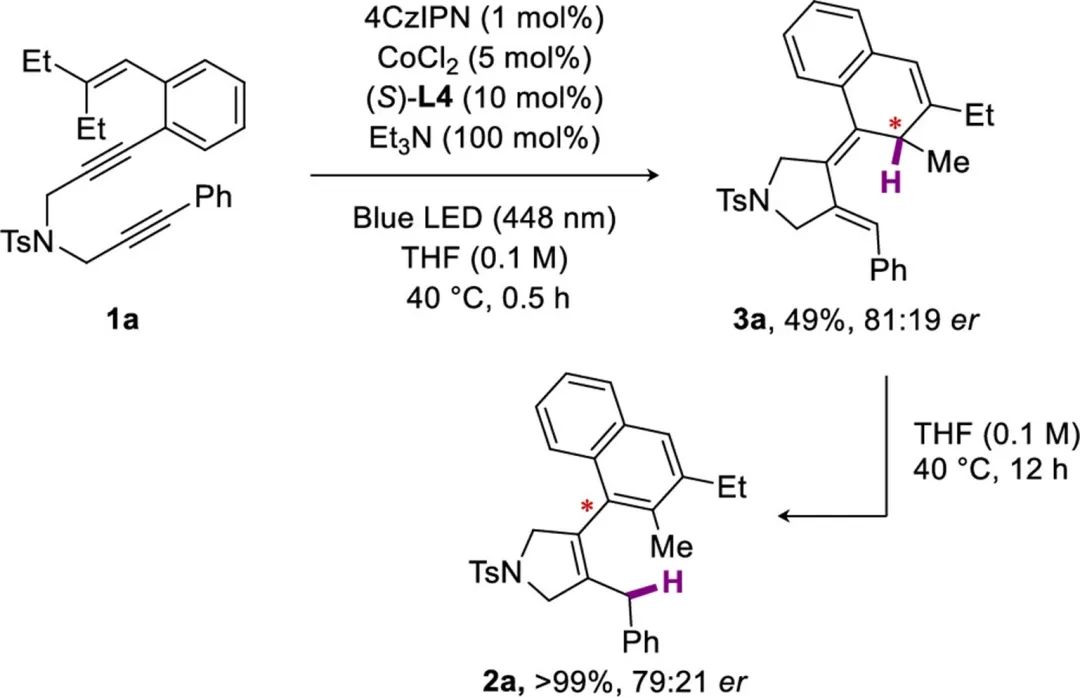
接下来,作者研究了手性配体的对映选择性反应。手性双萘骨架的单膦L1的加入可以合成中等对映选择性的2a(Table 2, entry 1)。亚磷酰胺配体L2和L3的加入提高了2a的对映选择性,但收率较低(Table 2, entry 2-3)。无需催化剂或光照,使用(S)-L4得到外环二烯中间体3a,对映异构体比为81:19(Scheme 5),说明了1,5-H位移的外消旋化可以忽略不计。
作者接下来使用(S)-L4和几种不同的烯二炔进行不对称反应(Scheme 6)。醚和丙二酸相连的烯二炔1b和1c的反应得到轴向手性芳基烯烃2b和2c,收率分别为74%和62%,对映异构体比相当(2b为74:26, 2c为72:28)。带有六元外环烯烃部分的烯二炔1h反应得到相应的产物2h,收率为67%,er为87:13。
总之,作者通过钴/有机光氧化还原双催化实现位点选择性C(sp3)–H键活化,开发了一种新的1,5,10-烯二炔的级联CMCA/1,5-H位移反应,从而得到各种轴向手性芳基烯烃。对照实验和DFT计算表明,C(sp3)–H键活化是通过三价金属中间体形成触发的σ-CAM进行的。此外,作者还成功使用手性亚磷酰胺配体的不对称反应合成了轴向手性1-萘取代的环烯烃,er值高达 87:13。
文章信息:
Cobalt/Organophotoredox Dual-Catalysis-Enabled Cyclization of 1,5,10-Enediynes Involving Metallole-Mediated Remote C(sp3)–H Bond Activation Leading to Axially Chiral Aryl Alkenes
Keiji Yamada, Nobuaki Koga, Takeshi Yasui,* and Yoshihiko Yamamoto*
ACS Catal. DOI: 10.1021/acscatal.3c05848
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





