德国马克斯普朗克煤炭研究所Tobias Ritter课题组:光诱导钯催化丁二烯1,4-氨基芳基化反应
钯催化的Heck偶联、Buchwald-Hartwig胺化反应以及与容易获得的芳基卤化物、烯烃和胺的氢胺化反应使C-C和C-N键的构建成为可能,从而彻底改变了学术和工业化学(图1A),但是芳基卤化物、丁二烯和胺用于氨芳化反应的三组分偶联反应迄今仍难以实现。在这里,来自德国马克斯普朗克煤碳研究所的Tobias Ritter教授课题组报道了在光诱导钯催化下1,3-丁二烯与芳基卤化物和胺的高度化学、区域和选择性的1,4-氨基芳基化反应。该转化是基于低价钯催化剂的光激发氧化加成,被二烯的自由基加成打断,这导致了单电子自由基Heck-Tsuji Trost烯丙基化级联途径。与传统的多步合成工艺不同,烯丙胺的合成是以E构型选择性地在一步完成的,作者以抗心律失常药物氯氟溴铵的合成为例进行了说明。温和的反应条件允许广泛的官能团和生物活性分子,这些官能团和生物活性分子通常与传统的钯催化不相容。
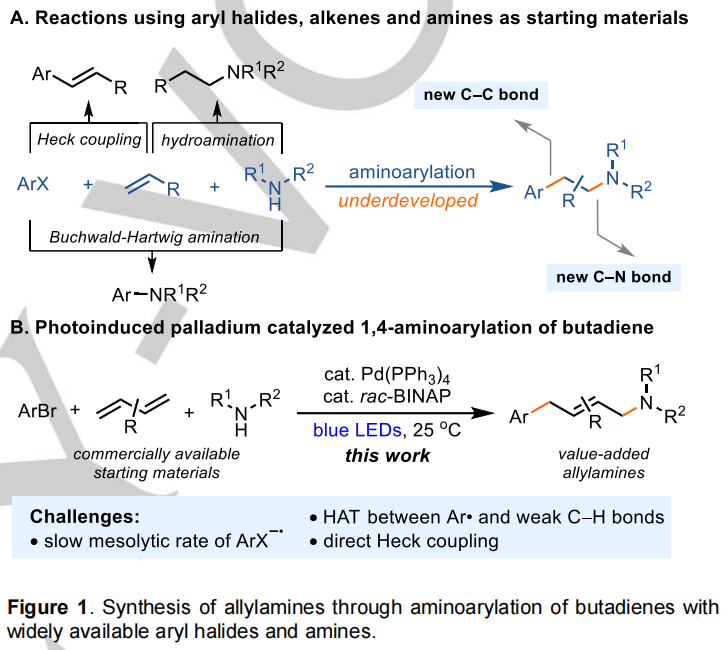
丁二烯的氨基功能化为合成烯丙胺提供了一条直接的途径,消除了对预官能化烯烃的需求,减少了合成步骤。过渡金属催化的丁二烯三组分双官能化目前可用于碳硅化、碳硼化和二羰基化,然而,高选择性的二烯氨基芳基化仍然是一个具有挑战性的任务。Heck报道了钯催化的二烯氨基芳基化反应,但它需要过量的胺(2.5-30当量),并且仍然产生显著的Heck偶联副产物(20-60%),这表明从烯丙基钯络合物中消除β-H的速度与用胺取代的速度相当。目前丁二烯的氨基芳基化反应仅限于两组分体系,其中三个反应伙伴中有两个是被束缚的。利用丁二烯作为有效的自由基捕捉剂的效率,也开发了自由基介导的三组分氨基功能化。虽然丁二烯的二胺化、氨氧基化、氨氰化和氨基烷基化已经成功实现,但丁二烯的自由基介导的氨芳基化还没有高选择性。总的来说,目前还缺乏一个通用和实用的丁二烯氨基芳基化生成烯丙胺的平台,无论是传统的双电子过渡金属催化还是基于自由基的方法都是如此。
受到Glorius和Gevorgyan等人报道的光诱导钯催化丁二烯氨基烷基化反应的启发,作者推测丁二烯的氨基芳基化反应可以利用芳基卤化物作为芳基自由基前驱体来实现。虽然烷基和芳基卤化物都具有高度负的还原电位,但通过单电子转移(SET)从少电子的芳基溴化物和-氯生成芳基自由基是非常具有挑战性的,特别是当芳基卤化物阴离子(ArX-·)的介解键断裂速度很慢时(方案1)。缺电子的ArX-·介溶裂解速率较慢是因为芳环内电子离域的共振稳定。因此,ArX-·和光催化剂之间的无效反向电子转移(BET)是一个额外的挑战。芳烃上的供电子基团导致ArX-·的失稳,从而增加了介解裂解的速率;然而,这也导致芳基卤化物的还原电位更负,使得单电子还原更加困难。相反,对于烷基卤化物生成烷基自由基,理论和实验研究都表明,协同解离电子转移过程比与自由基阴离子中间体的两步过程更可取。这些考虑使得这里报道的丁二烯的氨基芳基化在概念上有别于Glorius,Gevorgyan和其他人报道的丁二烯的氨烷基化,并且代表了这里报道的这项工作的进展。与亲核的烷基相比,双亲的芳基更容易从胺的富电子的烯丙基和α-C-H键上抽取氢原子,这是由于极性匹配和更强的C(Sp2)-H键能。最后,由于形成热力学上更稳定的共轭芳基丁二烯,芳基卤化物的Heck偶联偏好比烷基卤化物更高。由于这些因素,与烷基卤化物相比,芳基卤化物作为合成有用的芳基自由基前驱体用于烯烃功能化的情况很少,并且它们在丁二烯功能化中的应用还没有报道。作为作者在烯烃芳基功能化领域正在进行的研究的一部分,作者试图开发一种实用和广泛适用的方法,利用容易获得的芳基卤化物和胺进行丁二烯的氨基芳基化反应(图1B)。
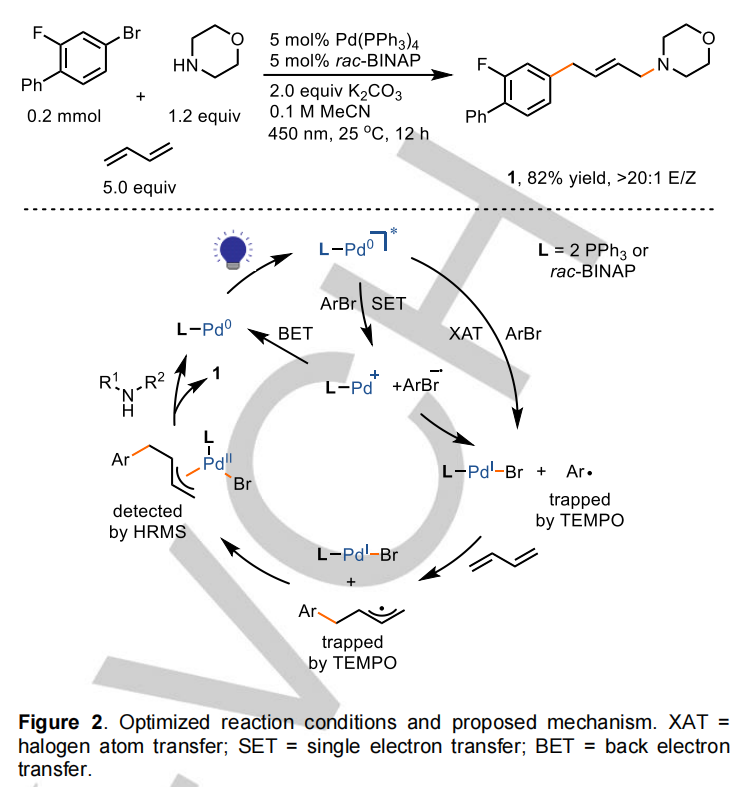
对反应条件的优化表明,Pd(PPh3)4和rac-BINAP在蓝光下催化丁二烯的1,4-氨基芳基化加成反应是有效的,以82%的产率生成了烯丙胺(E)-1。用5.0当量丁二烯成功地将芳基溴加氢脱溴副产物降至5%以下。该反应表现出很高的区域和立体选择性,没有1,2-加成异构体,Z构型立体异构体的生成量不到2%。光催化条件还通过有效地避开与其他常见的两组分偶联反应相关的副产物的形成而导致高的化学选择性。例如,在经典的热条件(100-130℃)下经常观察到的Heck偶联副产物的形成被有效地抑制,这可能是由于较温和的可见光诱导条件,使得能够对烯丙基Pd(II)络合物进行亲核拦截。
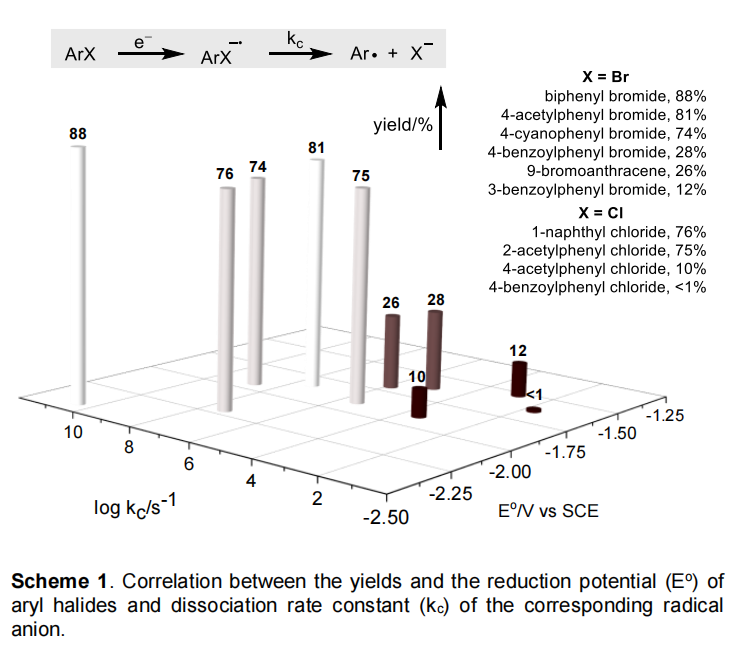
在作者的研究中观察到的较小的Hammett ρ值为0.5时,与通过卤素原子转移(XAT)生成的芳基自由基一致,但对芳烃π体系的键断裂步骤的极性贡献相对较小。然而,作者发现产率与速率常数Kc和还原电位之间存在正相关,如方案1所示,这与芳基自由基生成的SET/介解裂解途径一致。报道的Pd(PPh3)4(-2.51V vs Fc+/Fc)的还原电位进一步支持了SET途径的合理性。这些发现不能区分XAT和SET途径。当芳基卤化物具有较高的Kc值和较大的负还原势时,前者可能更有利,而后者当芳基卤化物更容易还原或相应的自由基阴离子能够稳定时,则更有利于前者。在激发的Pd(0)存在下,通过XAT或SET/均裂裂解途径生成芳基自由基之后,通过芳基自由基加成和氧化连接,然后是Tsuji-Trost烯丙基化,形成烯丙基钯(II)物种,从而产生烯丙胺产物。
虽然芳基卤化物阴离子的介解裂解速率(kc)几十年来在物理有机化学领域得到了很好的确定,但它在有机反应中的应用和讨论却很少。如方案1所示,芳基溴化物和-氯化物的产率较高(>74%),kc>105 s-1,而如果kc较小,则可能是由于ArX-·和Pd(I)物种之间的BET造成的无效产物的形成(图2)。此外,与传统的过渡金属催化相比,传统的过渡金属催化对电子丰富的芳基卤化物的反应速度较慢,具有更多的负还原电位。无论使用的是芳基溴化物还是氯化物,本文给出的反应底物都表现出很高的反应活性。尽管溴苯甲醚的还原电位为极负(-2.72V vs SCE),但它也可以参与(见SI,表S2),这在以芳基卤化物为芳基自由基前体的反应中是罕见的,可归因于直接的XAT途径或激发的Pd(0)的强烈还原能力。
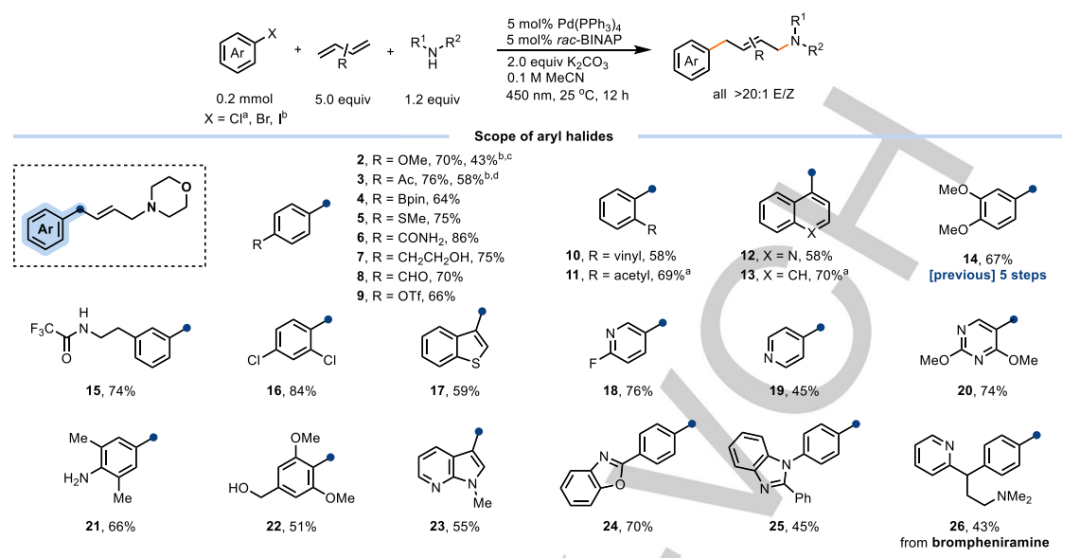
方案2总结了使用商用(杂化)芳基溴化物、胺和丁二烯对底物范围的进一步评估。烯丙胺通常以中等到高产率(43-89%)获得,由于使用丁二烯时反应具有高的化学、区域和立体选择性。芳基卤化物上的富电子基团、中性基团和贫电子基团都表现出良好的配伍性,支持芳基自由基自组分位于芳环内的观点,从而将给电子或吸电子取代基对反应活性的影响降至最低。
具有很强亲核性的次级脂肪胺,包括单环胺、双环胺和无环胺,以及五元、六元和七元N-杂环,在反应中都有很好的耐受性。亲核性相对较弱的伯脂胺(41)表现出较低的反应性,并伴随有Heck偶联副产物的形成,这可归因于与烯丙基Pd(II)物种的反应速度较慢(见SI,表S4)。亲核性较弱的胺(42-44),如N-杂芳烃、苯胺、磺胺、亚胺和氨基甲酸酯,即使使用强碱进行去质子化,也无法在反应中产生所需的产物。因此,二次脂肪胺与酰胺和苯胺的选择性烯丙基化是可以实现的(15,21,38)。含胺的官能化药物的成功反应进一步证明了反应条件的稳健性(27-37)。
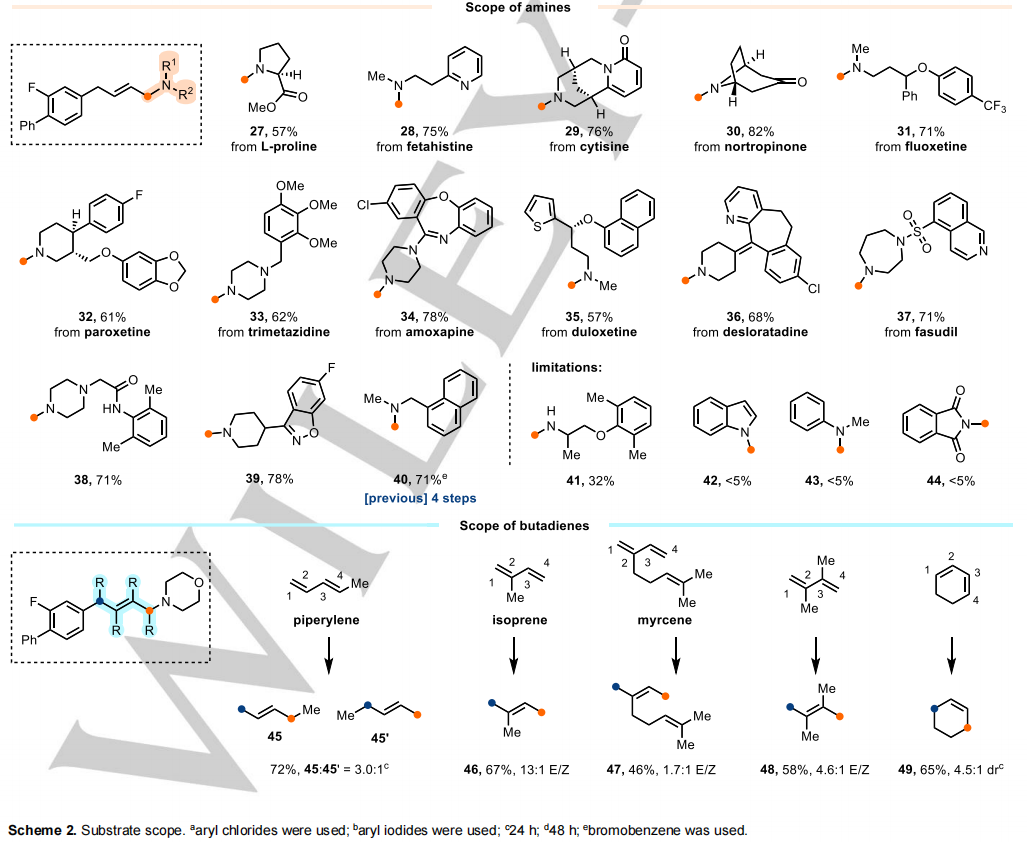
丁二烯上的取代基对氨基芳基化反应的活性和选择性有显著影响。1号位甲基取代基(亚丙基,45)的存在降低了反应速度,导致12小时后约60%的转化率,这可能是由于胺对取代的烯丙基Pd(II)中间体的亲核攻击速度较慢。另一方面,2号位取代基(46,47)不影响反应活性,但由于取代的烯丙基Pd(II)中间体中存在1,3-烯丙基,导致了Z/E异构体的混合。此外,2,3二取代丁二烯和1,3-环己二烯也是相容的,分别产生四取代(48)和环烯丙胺(49)。值得注意的是,在任何情况下都没有观察到1,2加成产物的形成。
与传统的多步骤合成不同,复杂的烯丙胺(14、40和50)是从商业上可获得的芳基溴化物、胺和丁二烯中一步得到的,突出了当前方法的效率(方案3)。因此,抗心律失常药物Clofilium(51)的合成步骤更少,产率更高,仅需丁二烯氨基芳基化、氢化和烷基化三步即可合成。

综上所述,本文报道了一种实用的丁二烯三组分氨基芳基化反应,该反应使用了现成的芳基卤化物和脂肪胺。光诱导钯催化剂的使用促进了芳基、2-丁烯基和氨基在室温下的顺序掺入,使复杂的芳基取代的烯丙胺的合成成为可能,这些复杂的芳基取代的烯丙胺通常需要经过多个步骤才能得到。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





