Science后再发Nat. Chem.:光催化亚磺酰胺实现烯烃的胺芳基化
最近,美国密歇根大学(University of Michigan)Corey R. J. Stephenson课题组利用芳基亚磺酰胺作为氨基和芳基双官能团供体,实现烯烃的光催化胺芳基化。反应中,光催化芳基亚磺酰胺生成的活性氮自由基,可以和烯烃发生自由基加成,经Smiles–Truce重排,生成芳乙胺化合物。相关研究成果发表在近期的Nature Chemistry上(Nat. Chem. DOI: 10.1038/s41557-023-01404-w)。同期发表的Cristina Nevado组研究工作,则利用手性芳基亚磺酰胺,实现内烯烃的不对称胺芳基化(Nat. Chem. DOI: 10.1038/s41557-023-01414-8)。
背景介绍和反应可行性研究(Fig. 1、2, Table 1):
苯乙胺(arylethylamines)是多种生物活性分子中存在的重要片段(Fig. 1A)。其芳烃和乙烯(ethylene)部位具有几个潜在的取代位点,可以作为调节分子代谢和药代动力学特征的合成手柄。然而,目前报道的从烯烃合成芳乙胺的方法,多需要共轭活化基团、导向基团、分子内底物设计或引入更高氧化态的氮原子。因此,发展出一种通用的烯烃胺芳基化反应具有重要研究价值。
密歇根大学Corey R. J. Stephenson课题组曾在2018年报道了富电子烯烃的胺芳基化反应(Science, 2018, 361, 1369–1373)。如Fig. 1b上图所示,富电子苯乙烯的自由基碳正离子被芳基磺酰胺氮原子捕捉生成环状中间体,然后发生去磺酰化芳基迁移(Smiles–Truce重排)生成双官能团化产物。由于此反应只兼容富电子烯烃,作者继续探索了非活化烯烃参与的胺芳基化反应,并于2022年报道了非活化烯烃和亲电性氮自由基(NCR)间的分子内胺芳基化反应(Fig. 1b下图, Chem. Sci., 2022, 13, 6942–6949)。但是,此方法所用磺酰胺芳环邻位需要有取代基(阻碍邻位加成发生),且会发生竞争性Smiles–Truce重排生成苯酚副产物(Fig. 1c上图),因此只适合分子内反应。为此,作者计划将硫原子氧化态从六价降低至四价,即将磺酰胺替换为亚磺酰胺,减弱基团离去能力从而抑制非理想重排反应发生(Fig. 1c下图)。
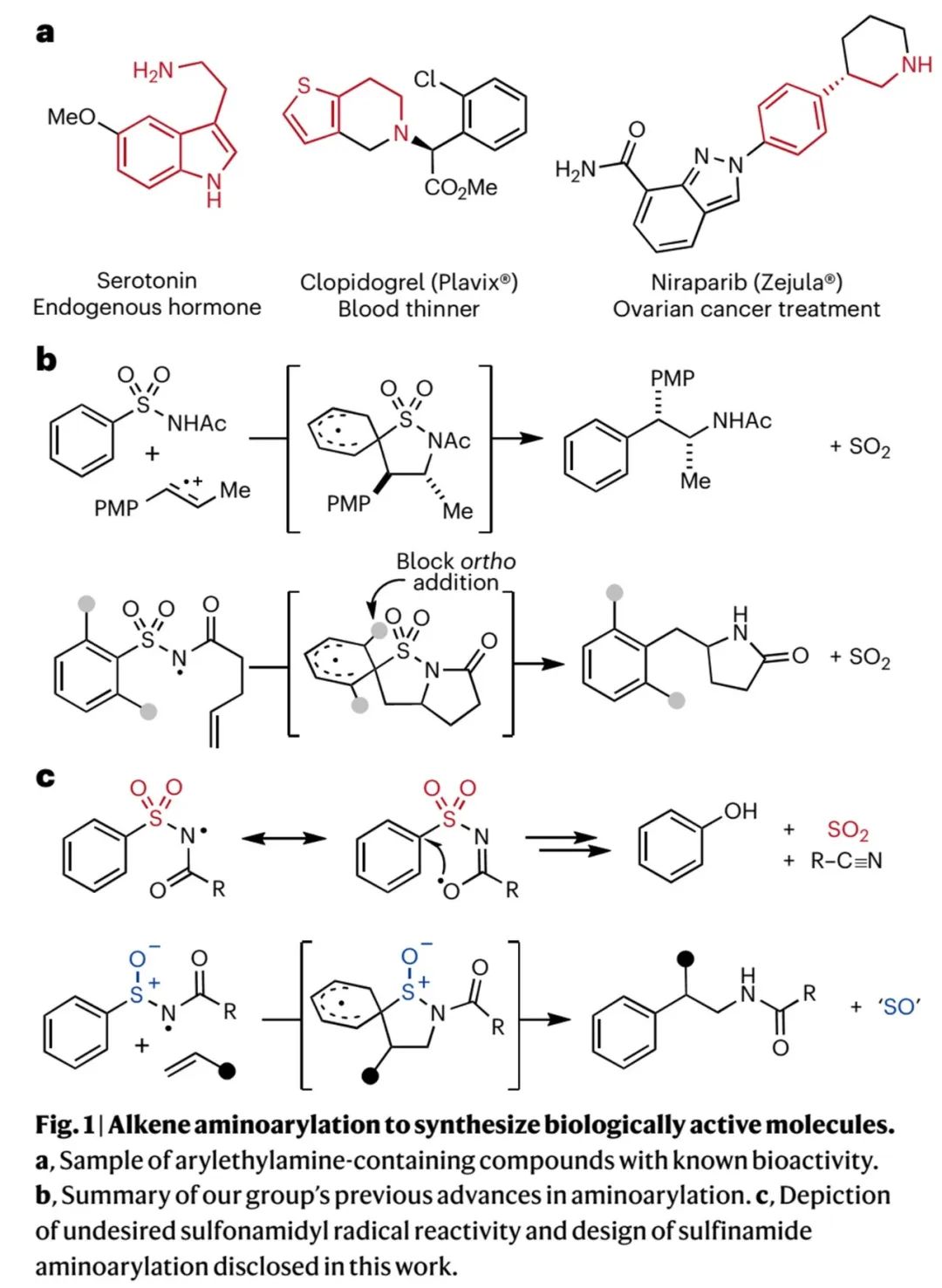
(Fig. 1,来源:Nat. Chem.)
Cristina Nevado、四川大学秦勇等课题组的相关报道都支持作者这一设想。此外,作者开展的循环伏安法测试结果显示(Fig. 2a),亚磺酰胺负离子相比磺酰胺负离子具有更弱的电势(0.74 V vs 1.49 V),因此亚胺酰胺能在弱氧化态光催化剂作用下生成理想亲电性氮自由基(NCR)。基于四川大学秦勇课题报道的反应条件(Angew. Chem. Int. Ed. 2018, 57, 6667 –6671),作者开展了反应可行性研究。如Fig. 2b所示,在光催化条件下,降冰片烯能和对甲苯基亚磺酰胺发生反应,以35%或30%的产率和高非对映选择性得到理想胺芳基化产物2。
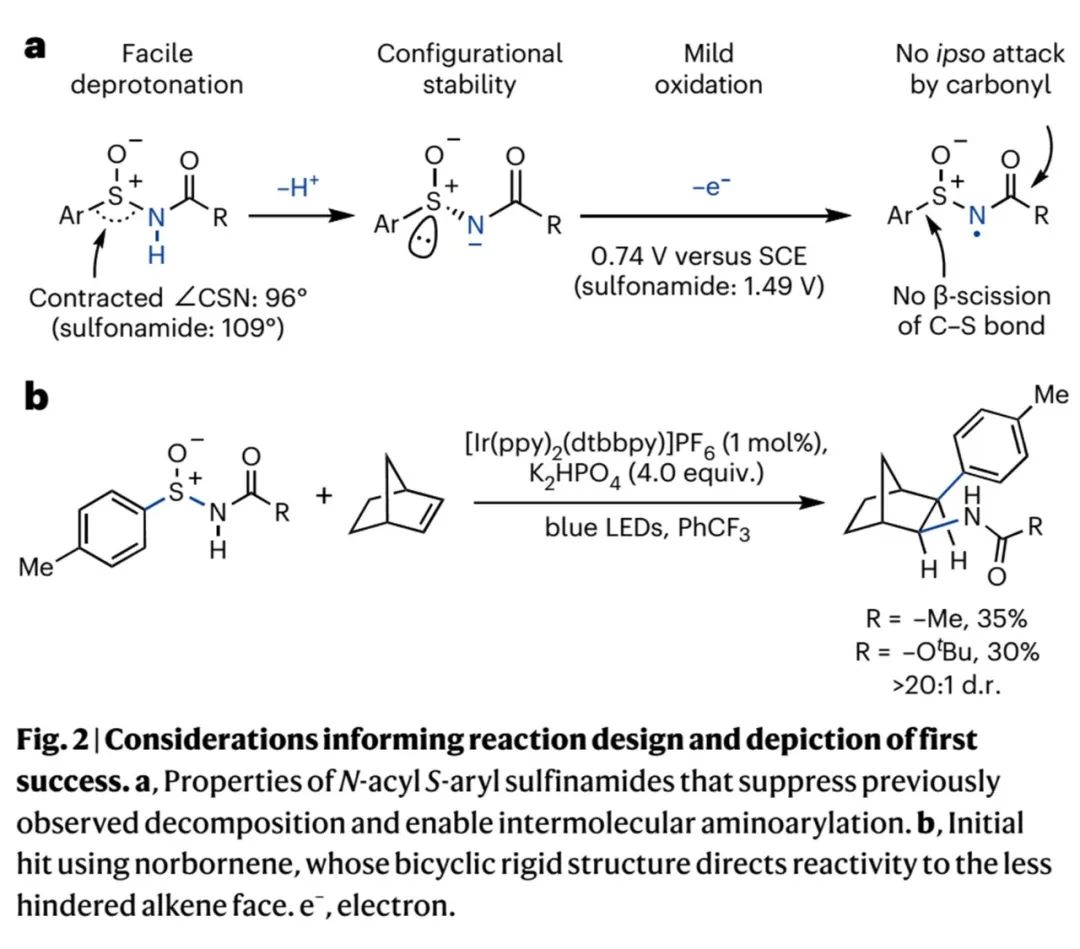
(Fig. 2,来源:Nat. Chem.)
基于Fig. 2b的初步研究,作者以4-氟代苯或3-氟代苯亚磺酰胺1和正辛烯为模板底物开展反应条件筛选研究。如Table 1所示,通过对亚磺酰胺、正辛烯当量、光催化剂、碱和碱当量、溶剂、反应液浓度等参数进行细致优化,得出如entry 20所示最优反应条件:Ir-1作光催化剂、3当量磷酸钾作碱、1:5 DCE/H2O作混合溶剂,反应能以89%的高产率得到理想胺芳基化产物2。水的加入有助于提高无机碱的溶解性。控制实验显示,光催化剂和无机碱对反应发生至关重要,缺一不可(entries 21、22)。
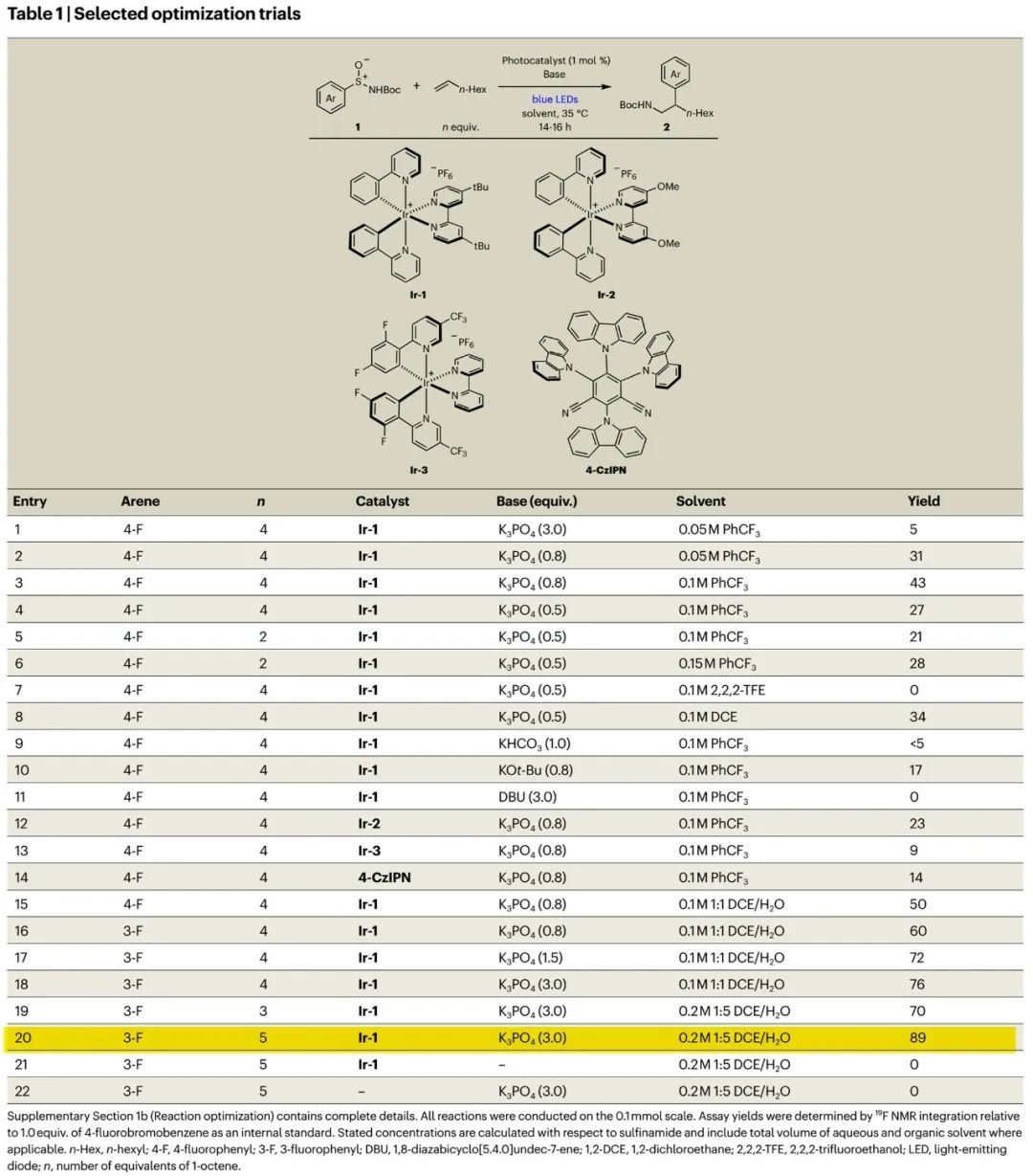
(Table 1,来源:Nat. Chem.)
底物拓展和应用研究(Table 2, Fig. 4):
以Table 1优化出的反应条件,作者接着开展底物拓展研究。如Table 2所示,多种芳基亚磺酰胺可以和各类烯烃发生胺芳基化反应,以可观产率和选择性得到对应产物2。反应兼容的底物包括:1)芳基对位带多种基团的亚磺酰胺(2a-2h),间二取代芳基亚磺酰胺(2i),邻位单取代芳基亚磺酰胺(2j、2k),邻二取代芳基亚磺酰胺(2l产率较低),萘取代亚磺酰胺(2m产率较低),噻吩、吡啶取代亚磺酰胺(2n、2o, Table 2a);2)单取代末端烯烃(2p-2t、2y、2z、2aa、2aq、2ar)、1,2-二取代烯烃(2u、2ab)、1,1-二取代烯烃(2v-2x)、三取代烯烃(2ac)、乙烯基醚(2ad-2am)、乙烯基氨基甲酸酯(2an-2ap)。反应兼容烯烃上的多种取代基,包括烷基、溴代烷基、杂环、醇羟基、酯基、吡啶、苯基、烯丙氧基、氨基甲酸酯、三甲基硅基、苯巯基等(Table 2b);3)氨基上用Cbz、Troc、Teoc、炔基取代酰基、吡唑取代酰基保护的芳基亚磺酰胺(2as-2aw, Table 2c)。总之,此胺芳基化反应具有优秀的底物和官能团兼容性。
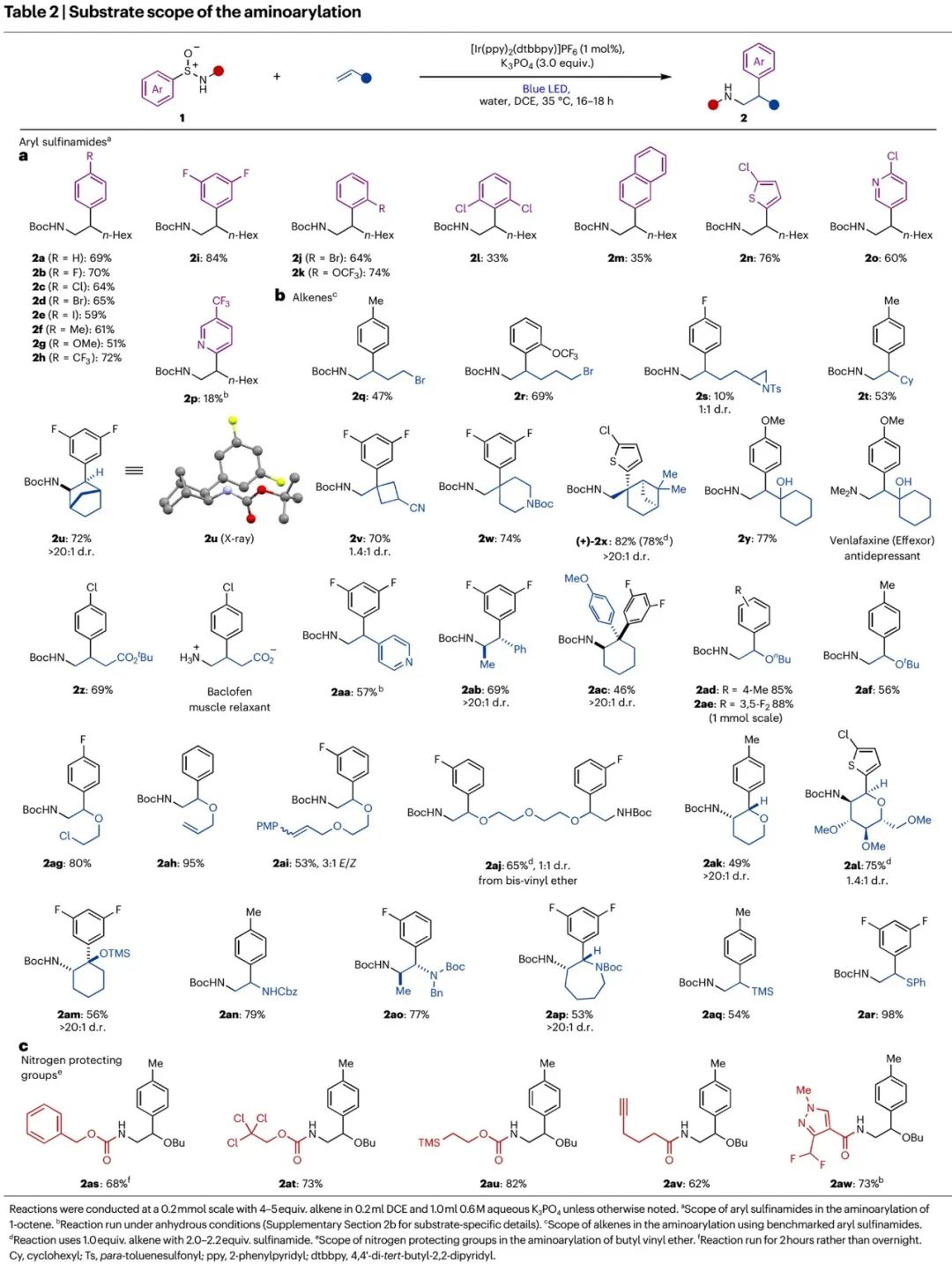
(Table 2,来源:Nat. Chem.)
为了进一步验证反应的应用价值,作者开展了后期转化和对映选择性研究。如Fig. 4a所示,底物拓展中所得产物2j、2q、2r、2ag,可以经Buchwald-Hartwig偶联或亲核取代环化,生成对应芳基杂环产物3j、3q、3r、3ag。使用手性芳基亚磺酰胺,可以对映选择性得到产物2q、2t(Fig. 4b)。2q可以环化成芳基杂环3q。降低反应温度有助于提高对映选择性。
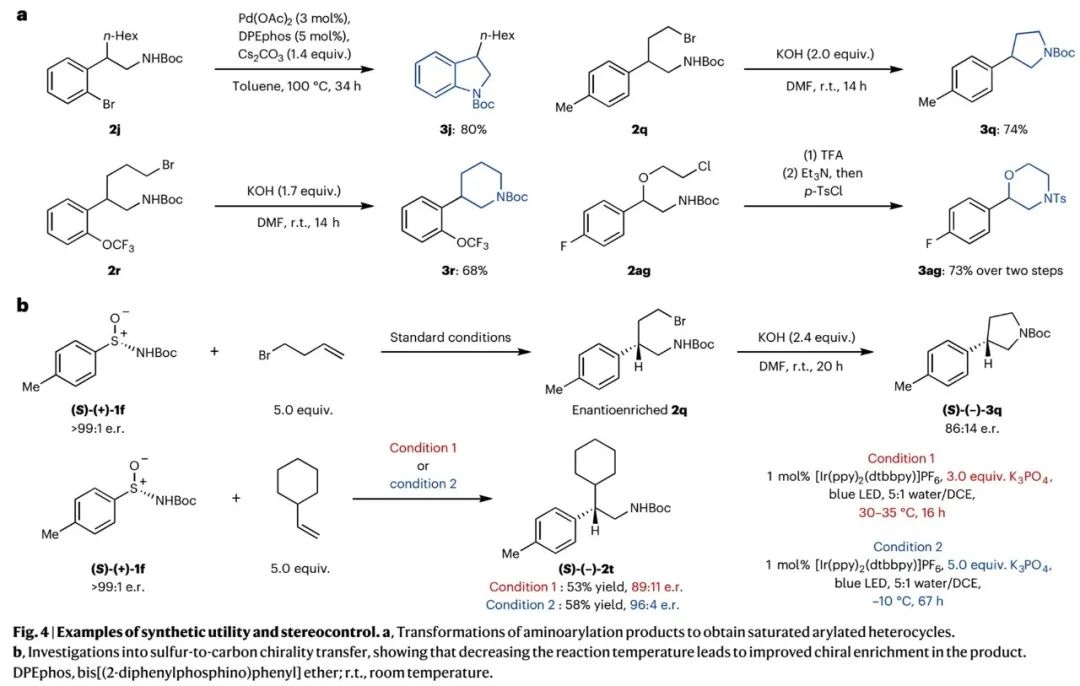
(Fig. 4,来源:Nat. Chem.)
反应机理研究(Fig. 3):
基于SI中Stern–Volmer荧光淬灭实验和负离子中间体循环伏安法测试所得结果,作者提出了如Fig. 3a所示SPLET可行性机理(sequential proton loss-electron transfer):芳基亚磺酰胺i去质子生成负离子中间体ii;ii被激发态*[Ir]II光催化剂氧化,得到芳基亚磺酰胺基自由基iii;iii和烯烃发生自由基加成,生成自由基加合物iv;iv经去芳构化螺杂环中间体v,发生Smiles–Truce重排,得到自由基中间体vi;vi可以经直接均裂或被[Ir]II光催化剂还原裂解离去SO,生成自由基或负离子中间体,再质子化得到产物vii。Fig. 3b的实验可以证明自由基中间体iv的生成,Fig. 3c的实验可以证明负离子中间体ii的生成。SO可以经歧化反应生成SO2和S2O。SO2可以在碱性水溶液中生成亚硫酸盐(HSO3–),并通过比色试纸检测出。
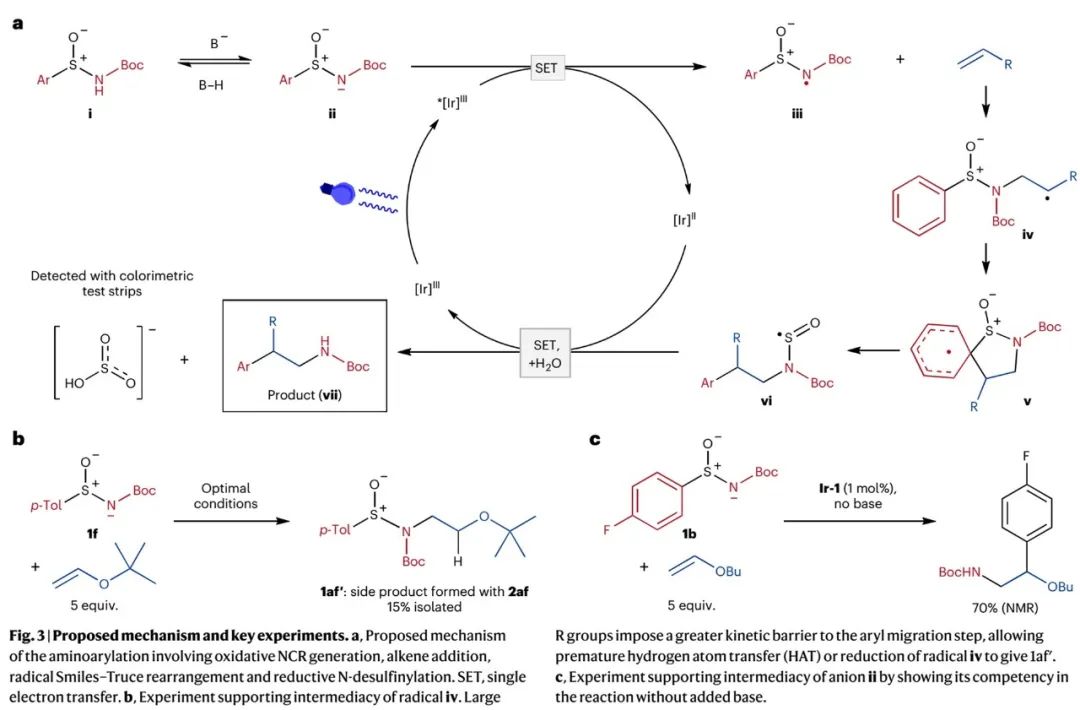
(Fig. 3,来源:Nat. Chem.)
Corey R. J. Stephenson课题组报道了一种烯烃和芳基亚磺酰胺参与的光催化烯烃胺芳基化反应。该反应具有优秀的区域选择性和非对映选择性,可以实现多种芳乙胺化合物的温和合成。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





