JACS:“光化学+有机催化”实现芳基氯化物与醇类合成硫醚
导读
近日,意大利博洛尼亚大学Paolo Melchiorre课题组报道了一种直接且无硫醇参与的有机催化策略,该策略可在温和的条件将廉价的醇和芳基氯化物结合在一起,合成了一系列芳基烷基硫醚。其中,该策略的关键之处在于四甲基硫脲可以作为简单的硫源,可拦截光化学生成的芳基自由基。为了形成该自由基,作者使用了一种易得的吲哚硫代物有机催化剂,当在405 nm的光激发时,该催化剂获得了强烈的还原能力,能够通过单电子转移活化典型的惰性芳基氯化物。随后,硫脲捕获自由基,然后通过极性路径进攻醇,从而形成硫醚产物。文章链接DOI:10.1021/jacs.3c13900。
(图片来源:J. Am. Chem. Soc.)
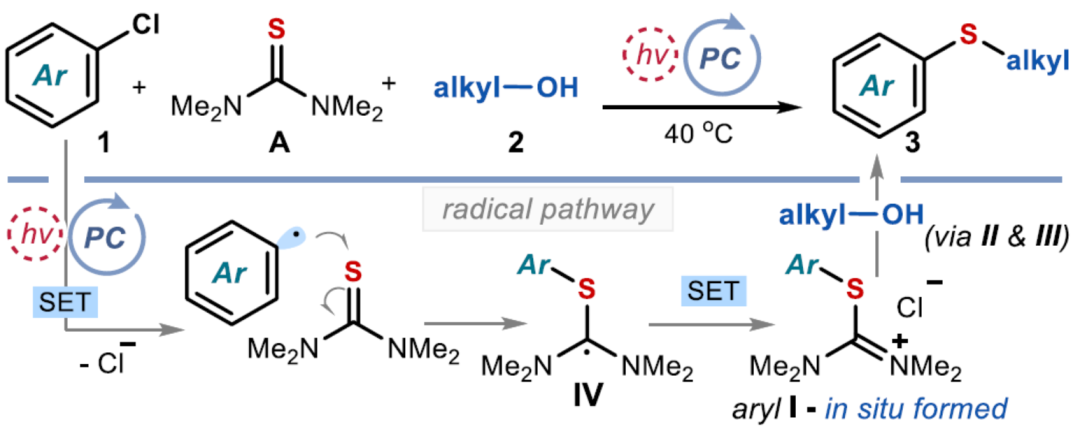
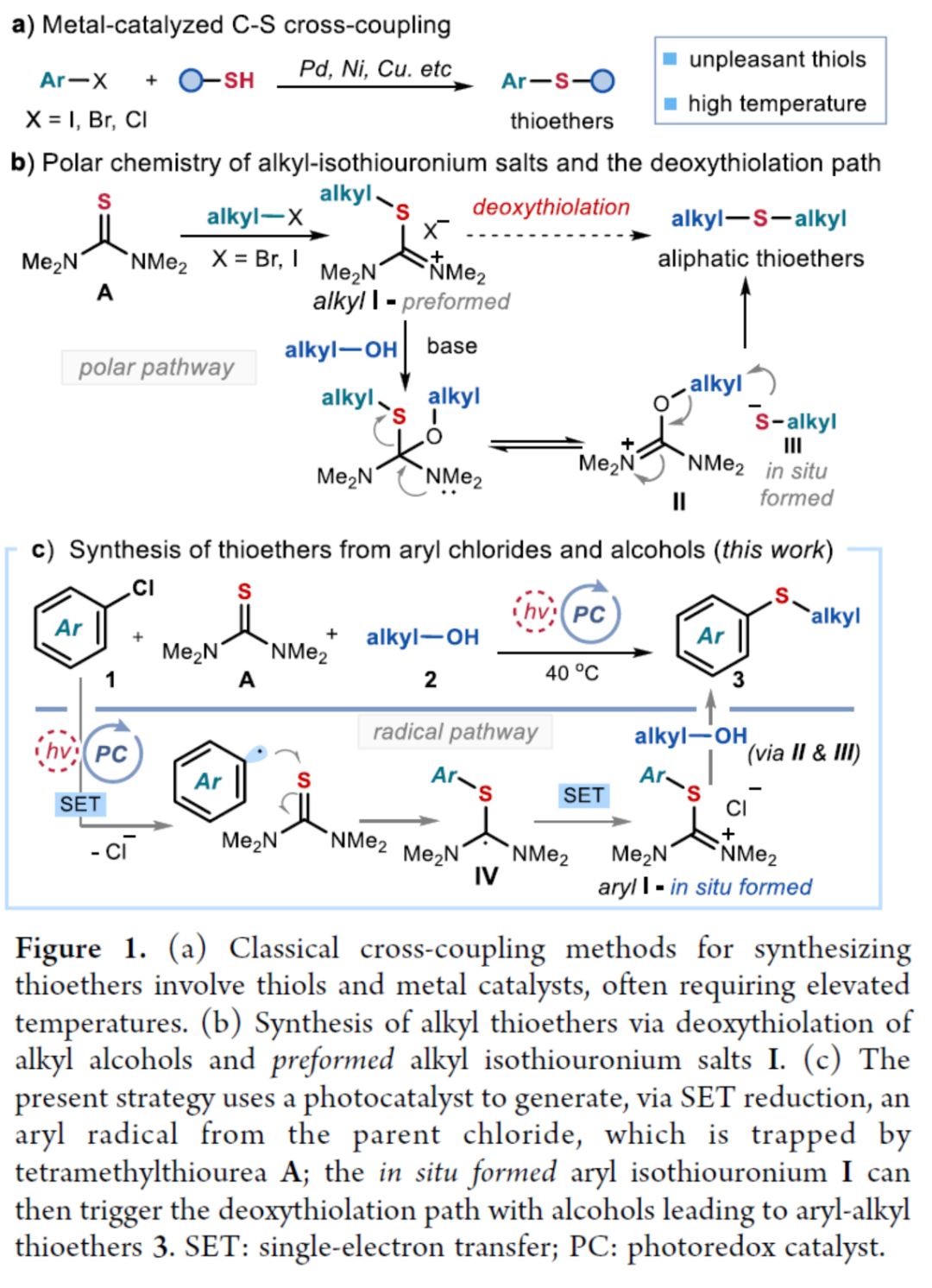
硫醚骨架广泛存在于天然产物与药物分子中,对癌症、HIV和Alzheimer等疾病具有生物活性。因此,设计有效合成硫醚化合物的方法引起了人们的极大兴趣。一个突出的策略涉及金属催化的芳基卤化物和硫醇的C−S交叉偶联(Figure 1a)。然而,此类反应常需使用高负载量的催化剂、专门的配体、高温和强碱的条件等。最近,化学家们开发了一种更有效的交叉偶联策略,不仅能够活化高活性的芳基溴化物和碘化物,而且能够活化更具成本效益和更容易获得的芳基氯化物,但这些交叉偶联策略在很大程度上依赖于硫醇(存在难闻的气味、空气不稳定性和种类有限等弊端)。作为合成硫醚的另一种策略,该策略不依赖硫醇或金属催化剂的使用,而仅依赖广泛易得的、廉价且稳定的化学品。具体而言,烷基异硫脲盐(alkylisothiouronium salts)I是通过四甲基硫脲A和烷基亲电试剂之间的SN2反应获得(Figure 1b)。随后,烷基醇亲核加成至预先形成的I中后生成半硫代缩醛(hemithioacetal),该半硫代缩醛在硫醇盐III释放时与异硫脲盐II达成平衡。最终,瞬态形成的III再进攻中间体II,遵循脱氧硫基化(deoxythiolation)极性途径,从而形成所需的二烷基硫醚。尽管这种不含金属和硫醇的方法可使用易得的底物,但其范围仅限于形成脂肪族产物。近日,意大利博洛尼亚大学Paolo Melchiorre课题组报道了一种光化学有机催化促进芳基氯化物与醇类化合物合成芳基烷基硫醚3的简单方法(Figure 1c)。
(图片来源:J. Am. Chem. Soc.)
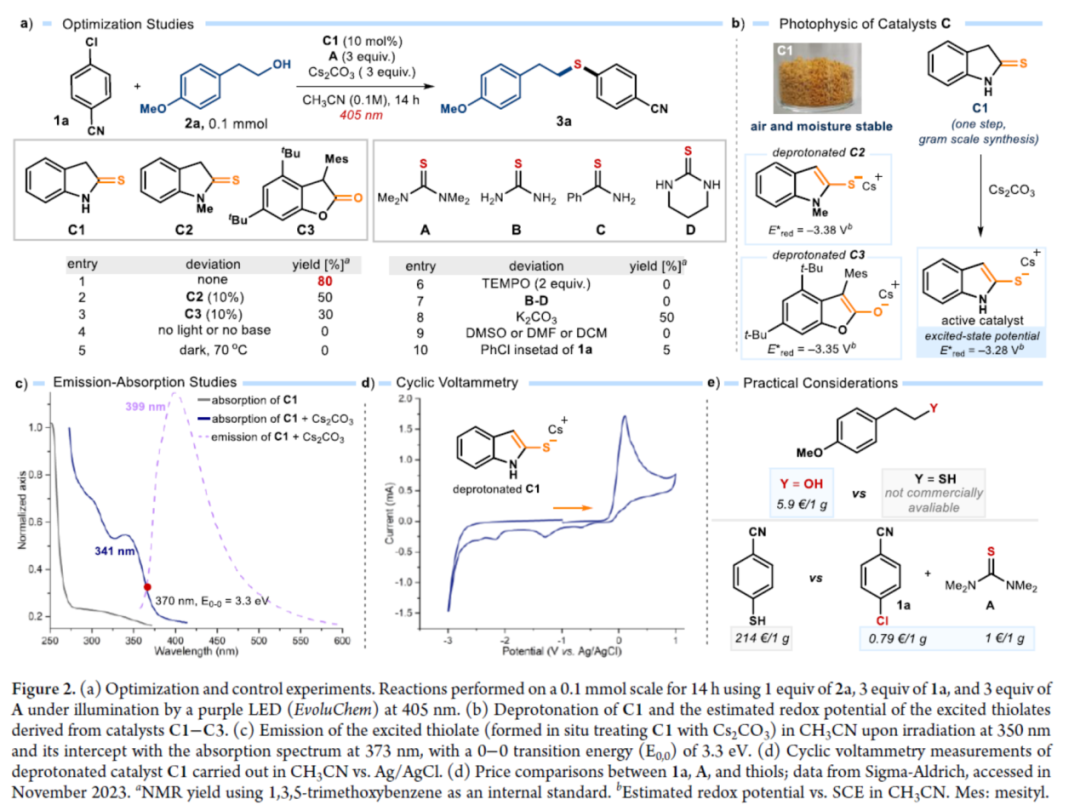
首先,作者以4-氯苯甲腈(自由基前体)1a与4-甲氧基苯乙醇(亲核试剂)2a作为模型底物,进行了相关偶联反应条件的筛选(Figure 2a)。当以1,1,3,3-四甲基硫脲A(10 mol %)作为硫源与自由基捕获剂,环状硫代酰胺C1(10 mol %)作为催化剂,Cs2CO3(3.0 equiv)作为碱,紫色发光二极管(405 nm)作为光源,在CH3CN溶剂中40 oC反应14 h,可以80%的收率得到硫醚产物3a。
同时,NMR研究和吸收光谱研究证实,在催化剂被Cs2CO3去质子化时生成的硫醇盐阴离子可以吸收可见光以进入电子激发态(Figures 2b and 2c)。发射光谱研究和CV实验结果表明,催化剂C1−C3的阴离子在激发时获得强烈的还原能力。在评估起始底物成本时,与硫醚制备的既定方案(如金属催化硫醇的交叉偶联)相比,该方法的实际效益更加出色(Figure 2e)。
(图片来源:J. Am. Chem. Soc.)
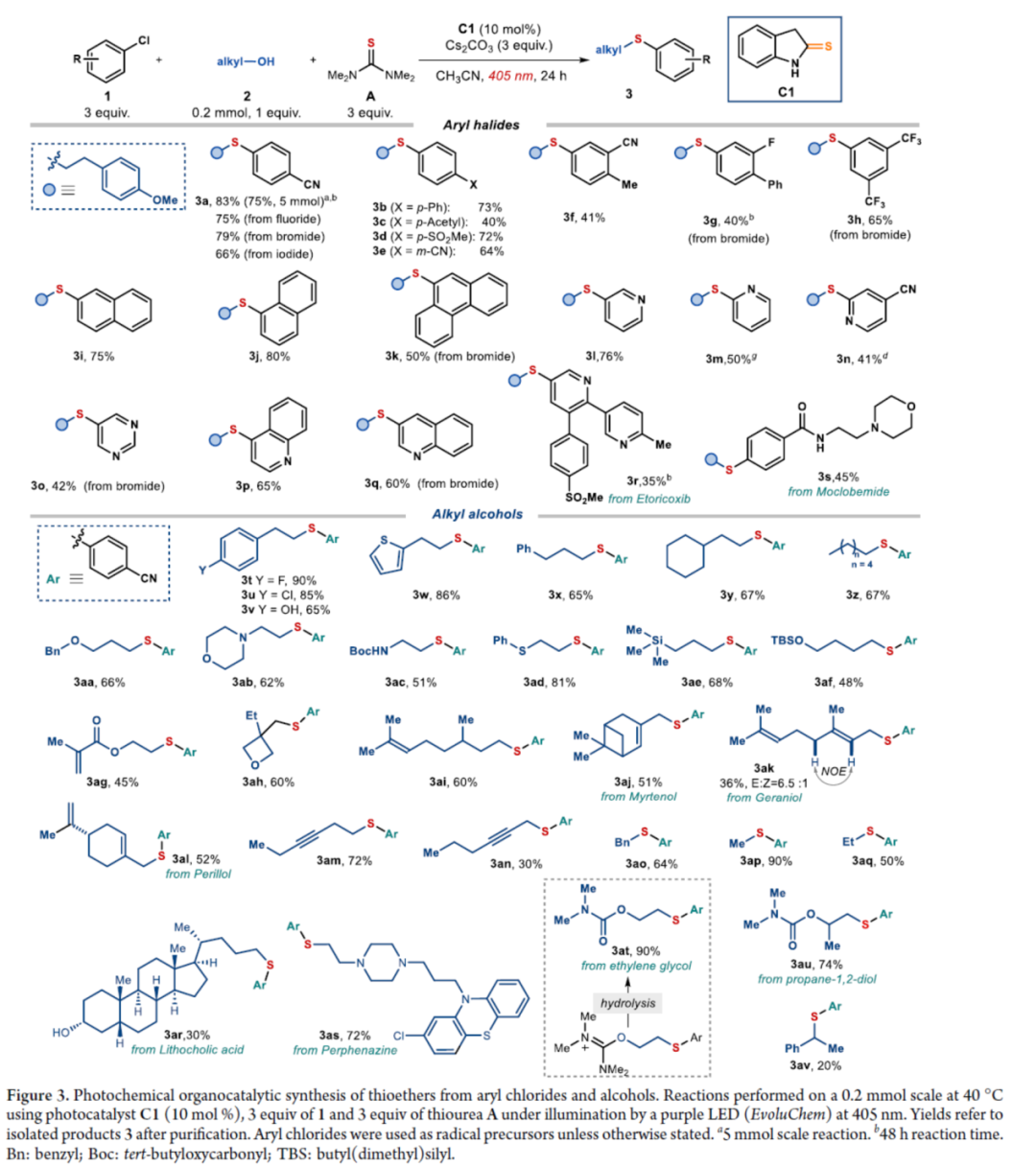
在获得上述最佳反应条件后,作者对芳基氯化物1与烷基醇2的底物范围进行了扩展(Figure 3)。首先,苯环上不同位置具有不同取代基的芳基卤化物,均可顺利反应,获得相应的产物3a-3h,收率为40-83%。含有多环芳香结构和N-杂环骨架的芳基卤化物,也是合适的底物,获得相应的产物3i-3q,收率为41-80%。值得注意的是,尽管收率适中,但仍实现了含氯药物分子如选择性COX-2抑制剂Etoricoxib(3r)和抗抑郁药吗氯贝胺(3s)的后期修饰。其次,一系列不同取代的一级醇底物,均与体系兼容,获得相应的产物3t-3an,收率为30-90%。值得注意的是,该策略具有出色的官能团兼容性,一系列活性的基团(如烯基、炔基、胺基等)均与体系兼容。同时,简单苄醇、甲醇和乙醇也可直接进行反应,获得相应的产物3ao-3aq,收率为50-90%。此外,该策略还可用于天然产物月桂醇(3aj)、香叶醇(3ak)、紫苏醇(3al)、石胆酸衍生物(3ar)和药物制剂奋乃静(3as)等复杂底物后期修饰,收率为30-72%。有趣的是,二醇底物仅有一个羟基进行选择性的硫醚化,而另一个醇部分转化为氨基甲酸酯(产物3at-3au),可能是异脲素鎓(isouronium)中间体的水解导致。
(图片来源:J. Am. Chem. Soc.)
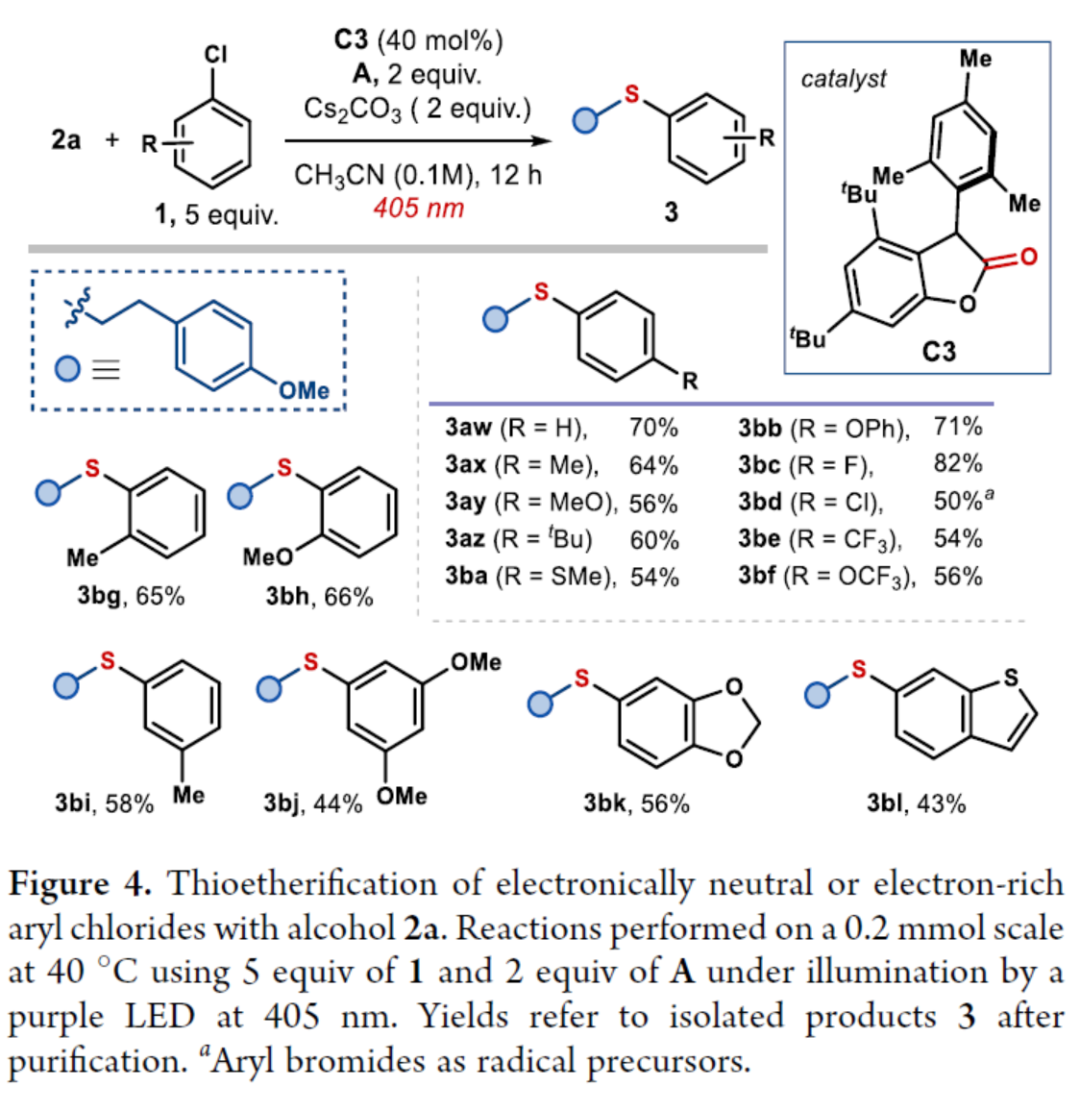
紧接着,作者发现,当使用C3作为催化剂时,该策略还可用于电中性或富电子的芳基氯化物的硫醚化反应(Figure 4)。研究结果表明,电中性芳基氯化物(3aw)和具有给电子基团的底物(3ax-3bb和3bj),均可顺利进行反应。同时,含有卤化物(3bc和3bd)、三氟甲基(3be-3bf)和噻吩(3bl)取代的底物,也与体系兼容。
(图片来源:J. Am. Chem. Soc.)
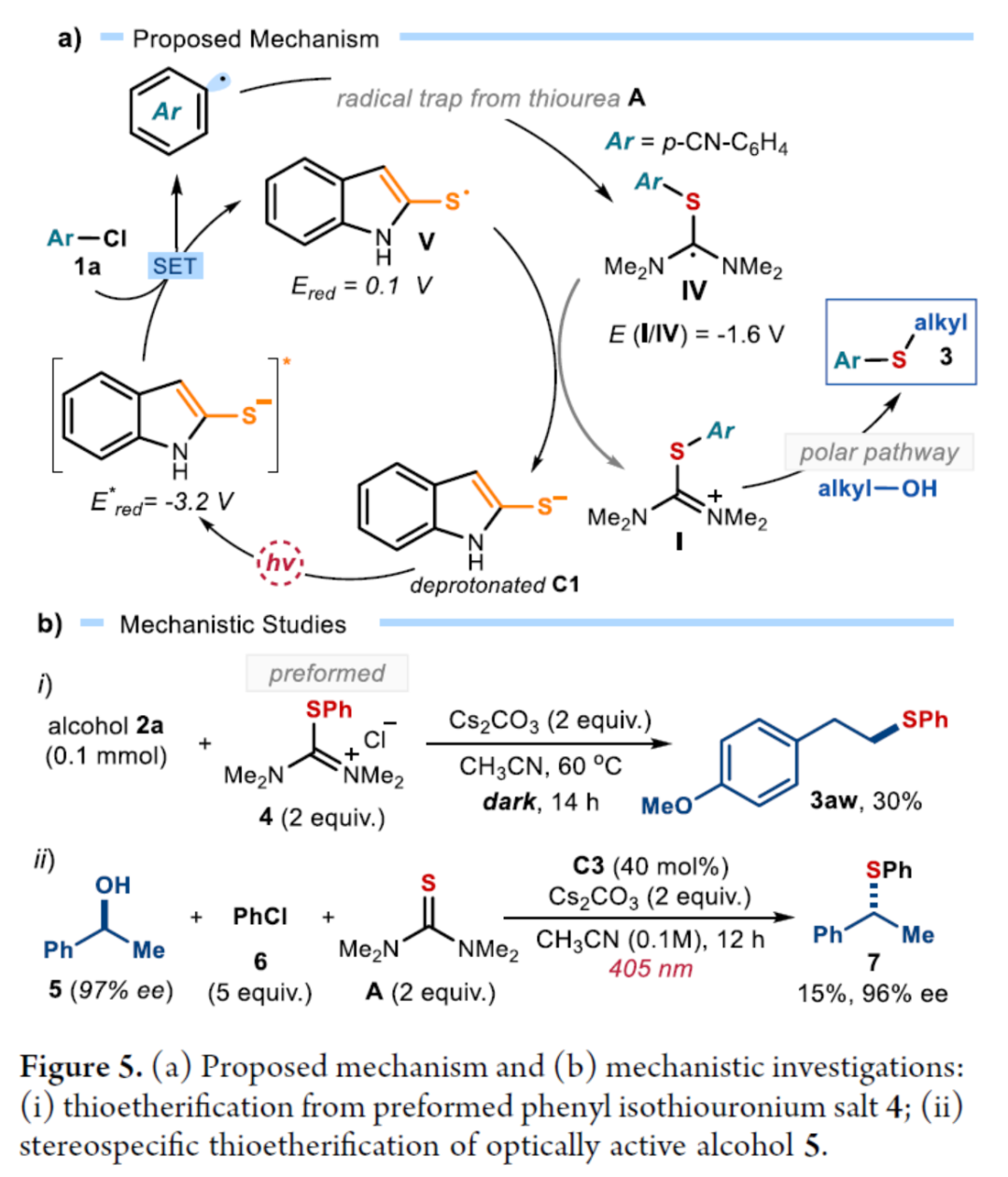
随后,作者提出了一种合理的催化循环过程(Figure 5a)。首先,激发的去质子化催化剂C1通过SET还原活化1a,生成芳基自由基。其次,芳基自由基可被四甲基硫脲A捕获,生成具有适当氧化还原电位的自由基IV。自由基IV通过SET还原,生成以硫为中心的自由基V,从而使催化剂C1翻转。然后,通过自由基途径原位形成了芳基异硫脲离子I,其经随后的极性脱氧硫基化(deoxythiolation)后生成芳基烷基硫醚3。此外,通过对机理的进一步研究发现(Figure 5b),该过程涉及立体特异性SN2离子途径。
(图片来源:J. Am. Chem. Soc.)
意大利博洛尼亚大学Paolo Melchiorre课题组报道了一种光化学催化策略,该策略能够在不涉及硫醇或过渡金属的情况下制备各种烷基芳基硫醚。该方法在温和的条件下通过使用容易获得的底物和催化剂进行操作。此外,该策略具有出色的官能团耐受性,并可用于一系列生物相关化合物的后期修饰。
声明:本文仅用于学术文章转载分享,不做盈利使用,如有侵权,请及时联系小编删除。





